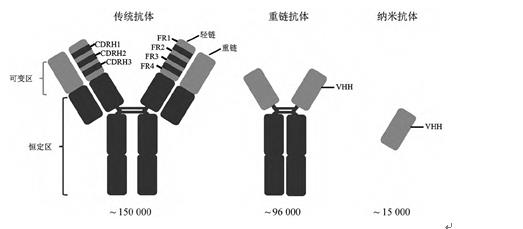
免疫球蛋白作为脊椎动物体液免疫中的重要效应分子,发挥着补体激活、抗原结合等作用,是机体适应性免疫中的“防卫兵”,主要分为Ig G、Ig M、Ig D、Ig E和Ig A五种类型。结构上,免疫球蛋白由两条相同的重链与两条相同的轻链结合成为典型的“Y”字形结构。重链与轻链均可分为可变区与恒定区,可变区发挥抗原结合作用,恒定区则主要进行下游的信号转导(图1)。多数哺乳动物的重链可变区基因均包含数目不等的可变区VH、DH、JH基因片段,恒定区基因则主要包含μ、δ、γ、ε和α五种类型。通过VDJ基因随机重组形成的可变区又可分为四个氨基酸组成的相对保守的框架区(framework region,FR)及三个氨基酸变化较大的互补决定区(heavy chain complementarity determining region,CDRH),其中CDRH3发挥着主要的抗原识别和结合作用。
1 牛免疫球蛋白研究进展
1.1 牛免疫球蛋白重链结构
之前的研究一直认为,牛基因组中存在两个有功能的免疫球蛋白重链基因位点[1]。而Ma等[2]对牛重链基因位点序列和结构信息进行了解析后,确定牛中只在21号染色体上含有一个有功能的重链基因位点,而之前被认为存在于11号染色体上的重链基因位点仅为一段类似基因,并无功能。不同于其他哺乳动物,牛的免疫球蛋白基因存在两个有功能的μ基因串联排列且两者之间的表达互不影响,其中μ2基因不仅可以直接转录表达,还可以通过类别转换重组的方式产生。
相较于小鼠和人,牛这样的反刍类哺乳动物中有功能的可变区基因片段十分有限且同源性较高,仅含有12个有功能的重链VH基因片段[3,4],4个有功能的重链JH基因片段[5]。而与其他哺乳动物的重链DH基因相比,牛的DH基因平均长度明显增加,其中长度为148 bp的IGHD8基因为目前哺乳动物中长的DH基因[6]。此外,牛的大部分DH基因长度都在30 bp以上,而小鼠中长的DH基因仅有29 bp。正是重链DH基因的长度多样化赋予了牛抗体多样性形成的独特机制[7]。
1.2 牛抗体多样性产生的新机制
除经典的VDJ重组、体细胞超突变和类别转换重组等抗体多样性产生机制外,牛还具有一些独特的多样性机制。相较于多数哺乳动物,牛抗体中重链CDRH3区平均长度明显增加,变化范围非常广泛,在3~70个氨基酸之间(小鼠与人中C D R H 3区域长度为1 2~1 4个氨基酸)。牛通过CDRH3长度多样性形成了数目庞大的抗体库,弥补了其可变区基因数目较少的不足[8]。此外,牛抗体中存在较多长度在5 0个氨基酸以上的超长CDRH3区。这种现象在其他哺乳动物中是不存在的,因此表达超长CDRH3也是牛抗体多样性产生的一个独特机制。
牛抗体中超长的CDRH3区域可通过数目不等、位置不同的二硫键来获得众多的抗原结合构型。此外该区域具有独特的“旋钮-茎”结构,可以结合一些特殊的抗原表位,且该区域不需要依赖其他部分,单独即可决定抗原特异性,而且牛体内产生的针对H I V的泛中和抗体也与超长CDRH3区域紧密相关[9]。
1.3 牛抗体的相关功能
牛血清中的Ig G能够介导T细胞活化以及病原体内化,这是诱导适应性病毒反应的先决条件。有研究表明,纯化的牛源Ig G具有结合呼吸道合胞体病毒RSV的能力,其在体内和体外均能促进适应性抗病毒的T细胞反应,防止RSV感染[10]。此外,牛Ig G可以预防胃肠道感染、上呼吸道感染和脂多糖等诱发的炎症反应。人们发现,牛结肠免疫球蛋白具有保护犊牛免受胃肠道细菌和病毒感染的能力[11]。牛不同的Ig G亚型在不同病原引发的免疫反应中发挥着不同的作用效果,如使用伯氏立克次氏体对牛进行免疫之后,Ig G2表现出显著的免疫应答水平[12]。
2 猪免疫球蛋白研究进展
2.1 猪重链基因组成
作为全球主要的肉食供应来源,猪在农业与商业领域具有重要应用价值。非洲猪瘟的爆发对中国的养猪行业造成了毁灭性的打击,对猪免疫球蛋白类型和表达的探索以及重链基因座位的解析是研制疫苗的关键。
与大多数哺乳动物相似,猪中也含有Ig M、Ig D、Ig G、Ig E和Ig A五种免疫球蛋白类型,其中Ig M、Ig E的氨基酸序列在各个猪种中相对保守,Ig D和Ig A在个别位点上存在突变[19]。但对于免疫球蛋白Ig G来说,其在猪中的分类较为复杂,命名也不统一[20,21]。Zhang等[19]通过对多种猪种中IGHG基因的铰链区、转换区以及跨膜区进行综合分析后,将IGHG基因划分为9个亚型,而不同猪种中的IGHG亚型数目各不相同。目前较为明确的是,长白猪中含有6种IGHG基因,分别为IGHG1、I G H G 3、I G H G 5-1、I G H G 5-2、I G H G 6-1以及IGHG6-2。而猪种约克夏、杜洛克以及小香猪中鉴定到的IGHG候选基因在2~6个不等。此外,由于猪中IGHG各亚型之间序列同源性较高,制备针对Ig G各亚型的特异性单克隆抗体较为困难。目前报道的单克隆抗体也仅有Ig G1、Ig G2以及Ig G3[19,22]。猪中Ig G亚型的不明确以及特异性单克隆抗体的缺乏大阻碍了养猪业中重大传染疾病相关疫苗的研发。
根据猪种的不同,其体内IGHV的基因数目在25~32个之间不等。这些基因均属于同一个家族,其中有功能的VH基因占比约为百分之50,且这些有功能的VH基因序列十分相似[23,24]。长久以来,人们都认为猪中仅存在4个DH基因。近期,Zhang等[19]通过分析不同猪种的基因组BAC序列,发现包括长白猪、二花脸、小香猪及杜洛克在内的猪中均含有5个DH基因,虽然新发现的DH3基因使用频率较低,但被归为有功能的DH基因。JH基因序列在各个猪种高度保守,共有5个,其中只有1个JH基因具有功能[25,26]。
2.2 猪抗体多样性形成特点
多数哺乳动物中均含有数量丰富的重链可变区VH、DH以及JH基因,而猪中可变区基因的数目十分有限,且猪在进行V-D-J重组时存在较强的基因使用偏好性。猪中基因转换的频率也相对较低,因此猪通过基因重组产生的多样性相对较少[27,28]。但研究表明,猪中由于存在CDR2和FR3两个高频的体细胞超突变区,其可变区基因的体细胞超突变频率可达10–2/bp,该频率为小鼠的十倍[19]。因此,猪中高频率的体细胞超突变是其抗体多样性形成的主要方式,也弥补了猪中可变区基因有限的不足。此外,与人和小鼠相比,猪中重链CDR3区域含有较多的半胱氨酸,也可进一步丰富免疫球蛋白的多样性。
2.3 猪抗体与疾病
猪在面对不同病原侵入时均可以检测到Ig G的产生,但详细的免疫应答情况不甚明确。Bjustrom-Kraft等[29]在感染猪流行性腹泻病毒猪的口腔及血清样品中均检测到猪流行性腹泻病毒相关Ig G的表达。而在蓝耳病感染的猪中,也能够检测到针对该疾病的特异性Ig G的产生[30]。这表明猪中较多的流行病均能引起Ig G的免疫应答,但目前并未有明确的报道来说明Ig G在相关疾病感染过程中的具体机制。
纳米抗体在实验室研究以及临床疾病的诊断与治疗方面具有重要的应用前景[38,39,40]。冠状病毒SARS-Co V-2爆发至今,研究者也先后在驼科动物体内筛选到了具有中和作用的纳米抗体。Hanke等[41]成功从羊驼体内筛选到了能够中和新冠病毒的纳米抗体Ty1,该抗体能与ACE2受体结合,从而有效中和病毒。Schoof等[42]通过酵母表面文库筛选获得了能与病毒S蛋白结合的纳米抗体序列,成功分离了能够中和SARS-Co V-2的纳米抗体。2019年,头一款纳米抗体药物Caplacizumab获美国食品药品监督管理局批准上市,用于治疗成年获得性血栓性血小板减少性紫癜患者,该药物可将再度发病的患者比例降低百分之67。纳米抗体作为一类新型的抗体类型,其自身所具备的优势不可小觑,利用这些优势来探索纳米抗体新的应用方向将成为下一个研究热点。
3 结论与展望
牛、羊以及猪等畜牧动物的免疫球蛋白重链均具有各自不同的基因组成与结构,在抗体多样性的产生方面也具有各自不同的特征。牛主要通过广泛的CDRH3长度多样性来弥补其可变区基因有限的不足;羊驼等驼科动物能产生特殊的重链抗体以应对复杂的抗原入侵;猪则通过众多的Ig G亚型及较高的体细胞超突变频率来获得充足的免疫球蛋白多样性。这些畜牧动物均可通过不同的多样性产生机制来产生足够的抗体多样性。
目前来说,牛抗体中超长的CDRH3区域所具有的特点可为新型抗体的发现与疾病疫苗的研究提供思路;驼科动物中的纳米抗体在疫苗研发、临床实验等方面的应用在如火如荼地进行中,未来的应用前景非常巨大;而对于猪来说,阐明各类Ig G亚型的功能将是抵御病毒性传染病在猪中广泛传播的关键。目前对羊、马等畜牧动物免疫系统的研究还十分有限,而系统了解畜牧动物免疫系统有益于畜牧动物疾病的防控,也可为提高畜牧动物肉类产量提供理论基础。因此,深入解析此类动物的免疫球蛋白分子信息也是提高畜牧动物商业应用的关键。
 鲁公网安备 37091102000658号
鲁公网安备 37091102000658号
 鲁公网安备 37091102000658号
鲁公网安备 37091102000658号